CuCl 2 + 4NH 3 = Cl 2
Na 2 + 4HCl = 2NaCl + CuCl 2 + 4H 2 O
2Cl + К 2 S = Cu 2 S + 2KCl + 4NH 3
При смешивании растворов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO 4 + Na 2 SO 3 + 2H 2 O = Cu 2 O + Na 2 SO 4 + 2H 2 SO 4
2CuSO 4 + 2Na 2 CO 3 + H 2 O = (CuOH) 2 CO 3 ↓ + 2Na 2 SO 4 + CO 2
Медь и соединения меди.
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17)Крастворухлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18)Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19)Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20)Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22)Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Поученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Медь. Соединения меди.
1. CuCl 2 Cu + Сl 2
на катоде на аноде
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
6NaOH (гор.) + 3Cl 2 = NaClO 3 + 5NaCl + 3H 2 O
2. CuCl 2 Cu + Сl 2
на катоде на аноде
CuS + 8HNO 3(конц. гор.) = CuSO 4 + 8NO 2 + 4H 2 O
или CuS + 10HNO 3(конц.) = Cu(NO 3) 2 + H 2 SO 4 + 8NO 2 + 4H 2 O
4NO 2 + 2Ba(OH) 2 = Ba(NO 3) 2 + Ba(NO 2) 2 + 2H 2 O
3. NaNO 3(тв.) + H 2 SO 4(конц.) = HNO 3 + NaHSO 4
Cu + 4HNO 3(конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
2NaNO 3 2NaNO 2 + O 2
4. Cu(NO 3) 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaNO 3
Cu(OH) 2 + 2HNO 3 = Cu(NO 3) 2 + 2H 2 O
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
CuO + 2HNO 3 = Cu(NO 3) 2 + H 2 O
5. 3Cu + 8HNO 3(разб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Cu(NO 3) 2 + 2КOH = Cu(OH) 2 ↓ + 2КNO 3
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
CuO + C Cu + CO
6. Hg(NO 3) 2 + Cu = Cu(NO 3) 2 + Hg
Cu(NO 3) 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaNO 3
(OH) 2 + 5H 2 SO 4 = CuSO 4 + 4NH 4 HSO 4 + 2H 2 O
7. Cu 2 O + 6HNO 3(конц.) = 2Cu(NO 3) 2 + 2NO 2 + 3H 2 O
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
4NO 2 + O 2 + 2H 2 O = 4HNO 3
10HNO 3 + 4Mg = 4Mg(NO 3) 2 + N 2 O + 5H 2 O
8. (CuOH) 2 CO 3 2CuO + CO 2 + H 2 O
CuO + H 2 Cu + H 2 O
CuSO 4 + Cu + 2NaCl = 2CuCl↓ + Na 2 SO 4
9. 3Cu + 8HNO 3(разб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
на катоде на аноде
2Na + O 2 = Na 2 O 2
2Na 2 O 2 + CO 2 = 2Na 2 CO 3 + O 2
10. (CuOH) 2 CO 3 2CuO + CO 2 + H 2 O
CuO + 2HNO 3 Cu(NO 3) 2 + H 2 O
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
11. CuO + H 2 SO 4 CuSO 4 + H 2 O
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
Cu(OH) 2 CuO + H 2 O
CuO + H 2 Cu + H 2 O
12. Cu + Cl 2 CuCl 2
CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl
Cu(OH) 2 CuO + H 2 O
CuO + C Cu + CO
13. Cu + 4HNO 3(конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
4NO 2 + O 2 + 2H 2 O = 4HNO 3
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
CuO + H 2 Cu + H 2 O
14. 2Cu + O 2 = 2CuO
CuSO 4 + NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Сu(OH) 2 + 4(NH 3 · H 2 O) = (OH) 2 + 4H 2 O
15. СuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
Cu(OH) 2 CuO + H 2 O
CuO + C Cu + CO
Cu + 2H 2 SO 4(конц.) = CuSO 4 + SO 2 + 2H 2 O
16) 2Cu + I 2 = 2CuI
2CuI + 4H 2 SO 4 2CuSO 4 + I 2 + 2SO 2 + 4H 2 O
Cu(OH) 2 CuO + H 2 O
17) 2CuCl 2 + 2Na 2 CO 3 + H 2 O = (CuOH) 2 CO 3 + CO 2 + 4NaCl
(CuOH) 2 CO 3 2CuO + CO 2 + H 2 O
CuO + H 2 Cu + H 2 O
3Cu + 8HNO 3(разб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
18) 3Cu + 8HNO 3(разб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
(OH) 2 + 3H 2 SO 4 = CuSO 4 + 2(NH 4) 2 SO 4 + 2H 2 O
19) Cu + 4HNO 3(конц.) = Cu(NO 3) 2 + 2NO + 2H 2 O
Сu(NO 3) 2 + 2NH 3 · H 2 O = Cu(OH) 2 ↓ + 2NH 4 NO 3
Cu(OH) 2 + 4NH 3 · H 2 O = (OH) 2 + 4H 2 O
(OH) 2 + 6HCl = CuCl 2 + 4NH 4 Cl + 2H 2 O
20) Fe + 2HCl = FeCl 2 + H 2
CuO + H 2 = Cu + H 2 O
Cu + 4HNO 3(конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
2Cu(NO 3) 2 + 2H 2 O 2Cu + O 2 + 4HNO 3
21) I 2 + 10HNO 3 = 2HIO 3 + 10NO 2 + 4H 2 O
4NO 2 + 2H 2 O + O 2 = 4HNO 3
Cu(OH) 2 + 2HNO 3 Cu(NO 3) 2 + 2H 2 O
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
22) Cu 2 O + 3H 2 SO 4 = 2CuSO 4 + SO 2 + 3H 2 O
СuSO 4 + 2KOH = Cu(OH) 2 + K 2 SO 4
Cu(OH) 2 CuO + H 2 O
3CuO + 2NH 3 3Cu + N 2 + 3H 2 O
23) CuO + H 2 SO 4 = CuSO 4 + H 2 O
4NO 2 + O 2 + 2H 2 O = 4HNO 3
10HNO 3 + 4Mg = 4Mg(NO 3) 2 + NH 4 NO 3 + 3H 2 O
24) CuO + CO Cu + CO 2
Cu + Cl 2 = CuCl 2
2CuCl 2 + 2KI = 2CuCl↓ + I 2 + 2KCl
CuCl 2 + 2AgNO 3 = 2AgCl↓ + Cu(NO 3) 2
25) 2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
CuO + H 2 SO 4 = CuSO 4 + H 2 O
2CuSO 4 + 2H 2 O 2Cu + O 2 + 2H 2 SO 4
Cu + 4HNO 3(конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
26) H 2 C 2 O 4 CO + CO 2 + H 2 O
CO 2 + Ca(OH) 2 = CaCO 3 + H 2 O
2Cu(NO 3) 2 2CuO + 4NO 2 + O 2
CuO + CO Cu + CO 2
27) Cu + 2H 2 SO 4(конц.) = CuSO 4 + SO 2 + 2H 2 O
SO 2 + 2KOH = K 2 SO 3 + H 2 O
СuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
Cu(OH) 2 + 2HCl CuCl 2 + 2H 2 O
Марганец. Соединения марганца.
I. Mарганец.
На воздухе марганец покрывается оксидной пленкой, предохраняющей его даже при нагревании от дальнейшего окисления, но в мелкораздробленном состоянии (порошок) он окисляется довольно легко. Марганец взаимодействует с серой, галогенами, азотом, фосфором, углеродом, кремнием, бором, образуя соединения со степенью +2:
3Mn + 2P = Mn 3 P 2
3Mn + N 2 = Mn 3 N 2
Mn + Cl 2 = MnCl 2
2Mn + Si = Mn 2 Si
При взаимодействии с кислородом марганец образует оксид марганца (IV):
Mn + O 2 = MnO 2
4Mn + 3O 2 = 2Mn 2 O 3
2Mn + O 2 = 2MnO
При нагревании марганец взаимодействует с водой:
Mn+ 2H 2 O (пар) Mn(OH) 2 + H 2
В электрохимическом ряду напряжений марганец находится до водорода, поэтому легко растворяется в кислотах, образуя соли марганца (II):
Mn + H 2 SO 4 = MnSO 4 + H 2
Mn + 2HCl = MnCl 2 + H 2
С концентрированной серной кислотой марганец реагирует при нагревании:
Mn + 2H 2 SO 4(конц.) MnSO 4 + SO 2 + 2H 2 O
С азотной кислотой при обычных условиях:
Mn + 4HNO 3 (конц.) = Mn(NO 3) 2 + 2NO 2 + 2H 2 O
3Mn + 8HNO 3 (разб..) = 3Mn(NO 3) 2 + 2NO + 4H 2 O
Растворы щелочей на марганец практически не действуют, но он реагирует с щелочными расплавами окислителей, образуя манганаты (VI)
Mn + KClO 3 + 2KOH K 2 MnO 4 + KCl + H 2 O
Марганец может восстанавливать оксиды многих металлов.
3Mn + Fe 2 O 3 = 3MnO + 2Fe
5Mn + Nb 2 O 5 = 5MnO + 2Nb
II. Соединения марганца (II, IV, VII)
1) Оксиды.
Марганец образует ряд оксидов, кислотно-основные свойства которых зависят от степени окисления марганца.
Mn +2 O Mn +4 O 2 Mn 2 +7 O 7
основный амфотерный кислотный
Оксид марганца (II)
Оксид марганца (II) получают восстановлением других оксидов марганца водородом или оксидом углерода (II):
MnO 2 + Н 2 MnO + H 2 O
MnO 2 + CO MnO + CO 2
Основные свойства оксида марганца (II) проявляются в их взаимодействии с кислотами и кислотными оксидами:
MnO + 2HCl = MnCl 2 + H 2 O
MnO + SiO 2 = MnSiO 3
MnO + N 2 O 5 = Mn(NO 3) 2
MnO + Н 2 = Mn + H 2 O
3MnO + 2Al = 2Mn + Al 2 O 3
2MnO + O 2 = 2MnO 2
3MnO + 2KClO 3 + 6KOH = 3K 2 MnO 4 + 2KCl + 3H 2 O
Оксиды - это бинарные соединения элемента с кислородом, находящимся в степени окисления (-2). Оксиды являются характеристическими соединениями для химических элементов . Неслучайно Д.И. Менделеев при составлении периодической таблицы ориентировался на стехиометрию высшего оксида и объединял в одну группу элементы с одинаковой формулой высшего оксида. Высший оксид - это оксид, в котором элемент присоединил максимально возможное для него количество кислородных атомов. В высшем оксиде элемент находится в своей максимальной (высшей) степени окисления. Так, высшие оксиды элементов VI группы, как неметаллов S, Se, Te, так и металлов Cr, Mo, W, описываются одинаковой формулой ЭО 3 . Все элементы группы проявляют наибольшее сходство именно в высшей степени окисления. Так, например, все высшие оксиды элементов VI группы - кислотные.
Оксиды - это самые распространенные соединения в металлургических технологиях .
Многие металлы находятся в земной коре в виде оксидов . Из природных оксидов получают такие важные металлы, как Fe, Mn, Sn, Cr.
В таблице приведены примеры природных оксидов, используемых для получения металлов.
| Ме | Оксид | Минерал |
| Fe | Fe 2 O 3 и Fe 3 O 4 | Гематит и магнетит |
| Mn | MnO 2 | пиролюзит |
| Cr | FeO . Cr 2 O 3 | хромит |
| Ti | TiO 2 и FeO . TiO 2 | Рутил и ильменит |
| Sn | SnO 2 | Касситерит |
2ZnS + 3O 2 = 2 ZnO + 2SO 2
Природные гидроксиды и карбонаты подвергают термическому разложению, приводящему к образованию оксида.
2MeOOH = Me 2 O 3 + H 2 O
MeCO 3 = MeO + CO 2
Кроме того, поскольку металлы, находясь в окружающей среде, окисляются кислородом воздуха, а при высоких температурах, характерных для многих металлургических производств, окисление металлов усиливается, необходимы знания о свойствах получаемых оксидов.
Приведенные выше причины объясняют, почему при обсуждении химии металлов оксидам уделяется особое внимание.
Среди химических элементов металлов - 85, и многие металлы имеют не по одному оксиду, поэтому класс оксидов включает огромное количество соединений, и эта многочисленность делает обзор их свойств непростой задачей. Тем не менее, постарается выявить:
- общие свойства, присущие всем оксидам металлов,
- закономерности в изменениях их свойств,
- выявим химические свойства оксидов, наиболее широко используемых в металлургии,
- приведем некоторые из важных физических характеристик оксидов металлов.
Оксиды металлов различаются стехиометрическим соотношением атомов металла и кислорода . Эти стехиометрические соотношения определяют степень окисления металла в оксиде.
В таблице приведены стехиометрические формулы оксидов металлов в зависимости от степени окисления металла и указано, какие именно металлы способны образовывать оксиды данного стехиометрического типа.
Помимо таких оксидов, которые в общем случае могут быть описаны формулой МеО Х/2 , где Х - это степень окисления металла, существуют также оксиды, содержащие металл в разных степенях окисления, например, Fe 3 O 4 , а также, так называемые, смешанные оксиды, например, FeO . Cr 2 O 3 .
Не все оксиды металлов имеют постоянный состав, известны оксиды переменного состава, например, TiOx, где x = 0,88 - 1,20; FeOx, где x = 1,04 - 1,12 и др.
Оксиды s-металлов имеют только по одному оксиду. Металлы p- и d- блоков, как правило, имеют несколько оксидов, исключение Al, Ga, In и d-элементы 3 и 12 групп.
Оксиды типа MeO и Ме 2 О 3 образуют почти все d-металлы 4 периода . Для большинства d-металлов 5 и 6 периодов характерны оксиды, в которых металл, находится в высоких степенях окисления ³ 4 . Оксиды типа МеО, образуют только Cd, Hg и Pd; типа Me 2 O 3 , помимо Y и La, образуют Au, Rh; серебро и золото образуют оксиды типа Ме 2 O.
Стехиометрические типы оксидов металлов
| Степень окисления | Тип оксида | Металлы, образующие оксид |
| +1 | Me 2 O | Металлы 1 и 11 групп |
| +2 | MeO | Все d -металлы 4 периода (кроме Sc), все металлы 2 и 12 групп , а также Sn, Pb; Cd, Hg и Pd |
| +3 | Me 2 O 3 | Почти все d -металлы 4 периода (кроме Cu и Zn), все металлы 3 и 13 групп , Au, Rh |
| +4 | MeO 2 | Металлы 4 и 14 групп и многие другие d-металлы: V, Nb, Ta; Cr, Mo, W; Mn, Tc, Re; Ru, Os; Ir, Pt |
| +5 | Me 2 O 5 | Металлы 5 и 1 5 групп |
| +6 | MeO 3 | Металлы 6 группы |
| +7 | Me 2 O 7 | Металлы 7 группы |
| +8 | MeO 4 | Os и Ru |
Структура оксидов
Подавляющее большинство оксидов металлов при обычных условиях - это твердые кристаллические вещества. Исключение - кислотный оксид Mn 2 O 7 (это жидкость темно-зеленого цвета). Лишь очень немногие кристаллы кислотных оксидов металлов имеют молекулярную структуру, это кислотные оксиды с металлом в очень высокой степени окисления: RuO 4 , OsO4, Mn 2 O 7 , Tc 2 O 7 , Re 2 O 7 .
В самом общем виде структуру многих кристаллических оксидов металлов можно представить как регулярное трехмерное расположение кислородных атомов в пространстве, в пустотах между кислородными атомами находятся атомы металлов. Поскольку кислород - это очень электроотрицательный элемент, он перетягивает часть валентных электронов от атома металла, преобразуя его в катион, а сам кислород переходит в анионную форму и увеличивается в размерах за счет присоединения чужих электронов. Крупные кислородные анионы образуют кристаллическую решетку, а в пустотах между ними размещаются катионы металлов. Только в оксидах металлов, находящихся в небольшой степени окисления и отличающихся небольшим значение электроотрицательности, связь в оксидах можно рассматривать как ионную. Практически ионными являются оксиды щелочных и щелочноземельных металлов. В большинстве оксидов металлов химическая связь оказывается промежуточной между ионной и ковалентной . С повышением степени окисления металла вклад ковалентной составляющей возрастает.
Кристаллические структуры оксидов металлов
Координационные числа металлов в оксидах
Металл в оксидах характеризуется не только степенью окисления, но и координационным числом , указывающим, какое количество кислородных атомов он координирует .
Очень распространенным в оксидах металлов является координационное число 6, в этом случае катион металла находится в центре октаэдра, образованного шестью кислородными атомами. Октаэдры так упаковываются в кристаллическую решетку, чтобы выдерживалось стехиометрическое соотношение атомов металла и кислорода. Так в кристаллической решетке оксида кальция, координационное число кальция равно 6. Кислородные октаэдры с катионом Ca 2+ в центре так объединяются между собой, что каждый кислород оказывается в окружении шести атомов кальция, т.е. кислород принадлежит одновременно 6 атомам кальция. Говорят, что такой кристалл имеет координацию (6, 6). Первым указывается координационное число катиона, а вторым аниона. Таким образом формулу оксида СаО следовало бы записать
СаО 6/6 ≡ СаО.
В оксиде TiO 2 металл также находится в октаэдрическом окружении кислородных атомов, часть кислородных атомов соединяется противоположными ребрами, а часть вершинами. В кристалле рутила TiO 2 координация (6, 3) означает, что кислород принадлежит трем атомам титана. Атомы титана образуют в кристаллической решетке рутила прямоугольный параллепипед.
Кристаллические структуры оксидов достаточно разнообразны. Металлы могут находиться не только в октаэдрическом окружении из кислородных атомов, но и в тетраэдрическом окружении, например в оксиде BeO ≡ BeO 4|4 . В оксиде PbO, также имеющем координацию кристалла (4,4), свинец оказывается в вершине тетрагональной призмы, в основании которой находятся атомы кислорода.
Атомы металла могут находиться в разном окружении кислородных атомов, например в октаэдрических и в тетраэдрических пустотах, и металл при этом оказывается в разных степенях окисления , как например, в магнетите Fe 3 O 4 ≡ FeO . Fe 2 O 3 .
Дефекты в кристаллических решетках объясняют непостоянство состава некоторых оксидов.
Представление о пространственных структурах позволяет понять причины образования смешанных оксидов. В пустотах между кислородными атомами могут находиться атомы не одного металла, а двух разных
, как например,
в хромите FeO .
Cr 2 O 3 .
Структура рутила
Некоторые физические свойства оксидов металлов
Подавляющее большинство оксидов при обычной температуре это твердые вещества. Они имеют меньшую плотность, чем металлы.
Многие оксиды металлов являются тугоплавкими веществами . Это позволяет использовать тугоплавкие оксиды как огнеупорные материалы для металлургических печей.
Оксид CaO получают в промышленном масштабе в объеме 109 млн т/год. Его используют для футеровки печей. В качестве огнеупоров используют также оксиды BeO и MgO. Оксид MgO один из немногих огнеупоров очень устойчивых к действию расплавленных щелочей.
Иногда тугоплавкость оксидов создает проблемы при получении металлов электролизом из их расплавов. Так оксид Al 2 O 3 , имеющий температуру плавления около 2000 о С, приходится смешивать с криолитом Na 3 , чтобы снизить температуру плавления до ~ 1000 о С, и через этот расплав пропускать электрический ток.
Тугоплавкими являются оксиды d-металлов 5 и 6 периодов Y 2 O 3 (2430), La 2 O 3 (2280), ZrO 2 (2700), HfO 2 (2080), Ta 2 O 5 (1870), Nb 2 O 5 (1490), а также многие оксиды d-металлов 4 периода (см. табл.). Высокие температуры плавления имеют все оксиды s-металлов 2 группы, а также Al 2 O 3 , Ga 2 O 3 , SnО,SnO 2 , PbO (см. табл.).
Низкие температуры плавления (о С) обычно имеют кислотные оксиды: RuO 4 (25), OsO 4 (41); Te 2 O 7 (120), Re 2 O 7 (302), ReO 3 (160), CrO 3 (197). Но некоторые кислотные оксиды имеют достаточно высокие температуры плавления (о С): MoO 3 (801) WO 3 (1473), V 2 O 5 (680).
Некоторые из основных оксидов d-элементов, завершающих ряды, оказываются непрочными, плавятся при низкой температуре или при нагревании разлагаются. Разлагаются при нагревании HgO (400 o C), Au 2 O 3 (155), Au 2 O, Ag 2 O (200), PtO 2 (400).
При нагревании выше 400 о С разлагаются и все оксиды щелочных металлов с образованием металла и пероксида. Оксид Li 2 O более устойчив и разлагается при температуре выше 1000 о С.
В таблице, приведенной ниже, приводятся некоторые характеристики d-металлов 4 периода, а также s- и p-металлов.
Характеристики оксидов s- и р-металлов
| Me | Оксид | Цвет | Т пл., оС | Кислотно-основной характер |
| s-металлы | ||||
| Li | Li 2 O | белый | Все оксиды разлагаются при T > 400 о С, Li 2 O при Т > 1000 o C |
Все оксиды щелочных металлов основные, растворяются в воде |
| Na | Na 2 O | белый | ||
| K | K 2 O | желтый | ||
| Rb | Rb 2 O | желтый | ||
| Cs | Cs 2 O | оранжевый | ||
| Be | BeO | белый | 2580 | амфотерный |
| Mg | MgO | белый | 2850 | основной |
| Ca | CaO | белый | 2614 | Основные, ограниченно растворяются в воде |
| Sr | SrO | белый | 2430 | |
| Ba | BaO | белый | 1923 | |
| p-металлы | ||||
| Al | Al 2 O 3 | белый | 2050 | амфотерный |
| Ga | Ga 2 O 3 | желтый | 1795 | амфотерный |
| In | In 2 O 3 | желтый | 1910 | амфотерный |
| Tl | Tl 2 O 3 | коричневый | 716 | амфотерный |
| Tl 2 O | черный | 303 | основной | |
| Sn | SnO | темно-синий | 1040 | амфотерный |
| SnO 2 | белый | 1630 | амфотерный | |
| Pb | PbO | красный | Переходит в желтый при Т > 490 о С | амфотерный |
| PbO | желтый | 1580 | амфотерный | |
| Pb 3 O 4 | красный | Разл. | ||
| PbO 2 | черный | Разл. При 300 о С | амфотерный | |
Характеристики оксидов d-металлов 4 периода
| Оксид | Цвет | r, г/см3 | Т пл., оС | - ΔGo, кДж/моль | - ΔHo, кДж/моль | Преобладающий Кислотно-основной характер |
|
| Sc | Sc 2 O 3 | белый | 3,9 | 2450 | 1637 | 1908 | основной |
| Ti | TiO | коричневый | 4,9 | 1780, p | 490 | 526 | основной |
| Ti 2 O 3 | фиолетовый | 4,6 | 1830 | 1434 | 1518 | основной | |
| TiO 2 | белый | 4,2 | 1870 | 945 | 944 | амфотерный | |
| V | VO | серый | 5,8 | 1830 | 389 | 432 | основной |
| V 2 O 3 | черный | 4,9 | 1970 | 1161 | 1219 | основной | |
| VO 2 | синий | 4,3 | 1545 | 1429 | 713 | амфотерный | |
| V 2 O 5 | оранжевый | 3,4 | 680 | 1054 | 1552 | кислотный | |
| Cr | Cr 2 O 3 | зеленый | 5,2 | 2335 p | 536 | 1141 | амфотерный |
| CrO 3 | красный | 2,8 | 197 p | 513 | 590 | кислотный | |
| Mn | MnO | Серо-зеленый | 5,2 | 1842 | 385 | 385 | основной |
| Mn 2 O 3 | коричневый | 4,5 | 1000 p | 958 | 958 | основной | |
| Mn 3 O 4 | коричневый | 4,7 | 1560 p | 1388 | 1388 | ||
| MnO 2 | коричневый | 5,0 | 535 p | 521 | 521 | амфотерный | |
| Mn 2 O 7 | зеленый | 2,4 | 6, 55 p | 726 | кислотный | ||
| Fe | FeO | Черный | 5,7 | 1400 | 265 | 265 | основной |
| Fe 3 O 4 | черный | 5,2 | 1540 p | 1117 | 1117 | ||
| Fe 2 O 3 | коричневый | 5,3 | 1565 p | 822 | 822 | основной | |
| Co | CoO | Серо-зеленый | 5,7 | 1830 | 213 | 239 | основной |
| Co 3 O 4 | черный | 6,1 | 900 p | 754 | 887 | ||
| Ni | NiO | Серо-зеленый | 7,4 | 1955 | 239 | 240 | основной |
| Cu | Cu 2 O | оранжевый | 6,0 | 1242 | 151 | 173 | основной |
| CuO | черный | 6,4 | 800 p | 134 | 162 | основной | |
| Zn | ZnO | белый | 5,7 | 1975 | 348 | 351 | амфотерный |
Кислотно-основной характер оксидов зависит от степени окисления металла и от природы металла.
Чем ниже степень окисления, тем сильнее проявляются основные свойства. Если металл находится в степени окисления Х £ 4 , то его оксид имеет либо основной, либо амфотерный характер.
Чем выше степень окисления, тем сильнее выражены кислотные свойства . Если металл находится в степени окисления Х ≥ 5 , то его гидроксид имеет кислотный характер.
Кроме кислотных и основных оксидов существуют амфотерные оксиды, проявляющие одновременно и кислотные и основные свойства .
Амфотерны все оксиды p-металлов, кроме Tl 2 O .
Из s -металлов только Be имеет амфотерный оксид.
Среди d-металлов амфотерными являются оксиды ZnO, Cr 2 O 3 , Fe 2 O 3 , Au 2 O 3 , и практически все оксиды металлов в степени окисления +4 за исключением основных ZrO 2 и HfO 2 .
Большинство оксидов, в том числе, Cr 2 O 3 , Fe 2 O 3 и диоксиды металлов проявляют амфотерность лишь при сплавлении со щелочами. С растворами щелочей взаимодействуют ZnO, VO 2 , Au 2 O 3 .
Для оксидов, помимо кислотно-основных взаимодействий, т. е. реакций между основными оксидами и кислотами и кислотными оксидами, а также реакций кислотных и амфотерных оксидов со щелочами, характерны также окислительно-восстановительные реакции.
Окислительно-восстановительные свойства оксидов металлов
Поскольку в любых оксидах металл находится в окисленном состоянии, все оксиды без исключения способны проявлять окислительные свойства .
Самые распространенные реакции в пирометаллургии - это окислительно-восстановительные взаимодействия между оксидами металлов и различными восстановителями, приводящие к получению металла.
Примеры
2Fe 2 O 3 + 3C = 4Fe + 3CO 2
Fe 3 O 4 + 2C = 3Fe + 2CO 2
MnO 2 +2C = Mn + 2CO
SnO 2 + C = Sn + 2CO 2
ZnO + C = Zn + CO
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3
WO 3 + 3H 2 = W + 3H 2 O
Если металл имеет несколько степеней окисления, то при достаточном повышении температуры становится возможным разложение оксида с выделением кислорода.
4CuO = 2Cu 2 O + O 2
3PbO 2 = Pb 3 O 4 + O 2 ,
2Pb 3 O 4 = O 2 + 6PbO
Некоторые оксиды, особенно оксиды благородных металлов, при нагревании могут разлагаться с образованием металла.
2Ag 2 O = 4Ag + O 2
2Au 2 O 3 = 4Au + 3O 2
Сильные окислительные свойства некоторых оксидов используются на практике. Например,
Окислительные свойства оксида PbO 2 используют в свинцовых аккумуляторах, в которых за счет химической реакции между PbO 2 и металлическим свинцом получают электрический ток.
PbO 2 + Pb + 2H 2 SO 4 = 2PbSO 4 + 2H 2 O
Окислительные свойства MnO 2 также используют для получения электрического тока в гальванических элементах (электрических батарейках).
2MnO 2 + Zn + 2NH 4 Cl = + 2MnOOH
Сильные окислительные свойства некоторых оксидов приводят к их своеобразному взаимодействию с кислотами. Так оксиды PbO 2 и MnO 2 при растворении в концентрированной соляной кислоте восстанавливаются.
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
Если металл образует несколько оксидов, то оксиды металла в более низкой степени окисления могут окисляться, т. е. проявлять восстановительные свойства.
Особенно сильные восстановительные свойства проявляют оксиды металлов в низких и неустойчивых степенях окисления, как например. TiO, VO, CrO. При растворении их в воде они окисляются, восстанавливая воду. Их реакции с водой, подобны реакциям металла с водой.
2TiO + 2H 2 O = 2TiOOH + H 2 .
Видеокурс «Получи пятерку» включает все темы, необходимые для успешной сдачи ЕГЭ по математике на 60-65 баллов. Полностью все задачи 1-13 Профильного ЕГЭ по математике. Подходит также для сдачи Базового ЕГЭ по математике. Если вы хотите сдать ЕГЭ на 90-100 баллов, вам надо решать часть 1 за 30 минут и без ошибок!
Курс подготовки к ЕГЭ для 10-11 класса, а также для преподавателей. Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.
Вся необходимая теория. Быстрые способы решения, ловушки и секреты ЕГЭ. Разобраны все актуальные задания части 1 из Банка заданий ФИПИ. Курс полностью соответствует требованиям ЕГЭ-2018.
Курс содержит 5 больших тем, по 2,5 часа каждая. Каждая тема дается с нуля, просто и понятно.
Сотни заданий ЕГЭ. Текстовые задачи и теория вероятностей. Простые и легко запоминаемые алгоритмы решения задач. Геометрия. Теория, справочный материал, разбор всех типов заданий ЕГЭ. Стереометрия. Хитрые приемы решения, полезные шпаргалки, развитие пространственного воображения. Тригонометрия с нуля - до задачи 13. Понимание вместо зубрежки. Наглядное объяснение сложных понятий. Алгебра. Корни, степени и логарифмы, функция и производная. База для решения сложных задач 2 части ЕГЭ.
Черный оксид Black oxide - Черный оксид .
Оксид черного цвета на поверхности металла, полученный в результате погружения в расплав или горячий раствор солей.
(Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО "Профессионал", НПО "Мир и семья"; Санкт-Петербург, 2003 г.)
Смотреть что такое "Черный оксид" в других словарях:
Оксид меди(II) … Википедия
Оксид меди(II) Общие Систематическое наименование Оксид меди(II)) Химическая формула … Википедия
У этого термина существуют и другие значения, см. Оксид ванадия. Оксид ванадия(III) Общие Химическая формула V2O3 Эмпирическая формула O3V2 Физические свойства … Википедия
Фосфор(P) Атомный номер 15 Внешний вид простого вещества Белый фосфор белый, восковидный, слегка фосфоресцирующий Свойства атома Атомная масса (молярная масса) 30,973762 а. е. м. (г/моль) Радиус атома … Википедия
Бисмутум оксидатум - Bismutum oxydatum, Висмута оксид - Встречается в виде природного минерала бисмита, получается также прокаливанием карбоната или нитрата висмута. Порошок лимонно желтого цвета В воде не растворяется. В гомеопатии используется химически чистый оксид висмута. Приготовление… … Справочник по гомеопатии
У этого термина существуют и другие значения, см. Ванадий (значения). 23 Титан ← Ванадий → Хром … Википедия
Существуют следующие хлориды хрома: Название Формула Температура плавления Температура кипения Цвет Оксид хрома(II) CrO черный Оксид хрома(III) Cr2O3 2440 °C 3000 °C зеленый Оксид хрома(IV) CrO2 … Википедия
Cu (cuprum), химический элемент IB подгруппы (семейства монетных металлов Cu, Ag, Au) периодической системы элементов. Известна и широко используется с древних времен (медный век, бронзовый век). Медь наряду с серебром и золотом используется для… … Энциклопедия Кольера
И; ж. 1. Химический элемент (Сu), ковкий металл желтого цвета с красноватым отливом (широко применяется в промышленности). Добыча меди. Надраить м. самовара. Изготовить из меди котелок. 2. собир. Изделия из этого металла. Вся м. в подвале… … Энциклопедический словарь
Действующее вещество ›› Железа сульфат + Фолиевая кислота* + Цианокобаламин* (Ferrous sulfate + Folic acid + Cyanocobalamin) Латинское название Ferro Folgamma АТХ: ›› B03AE01 Препараты железа в комбинации с витамином B12 и фолиевой кислотой… … Словарь медицинских препаратов
Несолеобразующие (безразличные, индифферентные) оксиды СО, SiO, N 2 0, NO.
Солеобразующие оксиды:
Основные. Оксиды, гидраты которых являются основания ми. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na 2 O - оксид натрия, СаО - оксид кальция, CuO - оксид меди (II), СоО - оксид кобальта (II), Bi 2 O 3 - оксид висмута (III), Mn 2 O 3 - оксид марганца (III).
Амфотерные. Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl 2 O 3 - оксид алюминия, Cr 2 O 3 - оксид хрома (III), SnO 2 - оксид олова (IV), МnO 2 - оксид марганца (IV), ZnO - оксид цинка, ВеО - оксид бериллия.
Кислотные. Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов. Примеры: Р 2 О 3 - оксид фосфора (III), СO 2 - оксид углерода (IV), N 2 O 5 - оксид азота (V), SO 3 - оксид серы (VI), Cl 2 O 7 - оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb 2 O 5 - оксид сурьмы (V). СrОз - оксид хрома (VI), МnОз - оксид марганца (VI), Мn 2 O 7 - оксид марганца (VII).
Изменение характера оксидов при увеличении степени окисления металла
Физические свойства
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета - твердые вещества. Оксид серы (VI) SO 3 - бесцветная летучая жидкость, а оксид углерода (IV) СО 2 - бесцветный газ при обычных условиях.
Агрегатное состояние
CaO, СuО, Li 2 O и др. основные оксиды; ZnO, Аl 2 O 3 , Сr 2 O 3 и др. амфотерные оксиды; SiO 2 , Р 2 O 5 , СrO 3 и др. кислотные оксиды.
SO 3 , Cl 2 O 7 , Мn 2 O 7 и др..
Газообразные:
CO 2 , SO 2 , N 2 O, NO, NO 2 и др..
Растворимость в воде
Растворимые:
а) основные оксиды щелочных и щелочноземельных металлов;
б) практически все кислотные оксиды (исключение: SiO 2).
Нерастворимые:
а) все остальные основные оксиды;
б) все амфотерные оксиды
Химические свойства
1. Кислотно-основные свойства
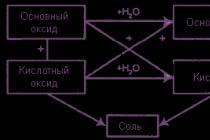
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:


(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO 2).

Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:

2. Окислительно - восстановительные свойства
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. - окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
2C +2 O + O 2 = 2C +4 O 2
2S +4 O 2 + O 2 = 2S +6 O 3
2N +2 O + O 2 = 2N +4 O 2
Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
C +2 O + FeO = Fe + 2C +4 O 2
C +2 O + H 2 O = H 2 + 2C +4 O 2
Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
C +4 O 2 + C = 2C +2 O
2S +6 O 3 + H 2 S = 4S +4 O 2 + H 2 O
C +4 O 2 + Mg = C 0 + 2MgO
Cr +3 2 O 3 + 2Al = 2Cr 0 + 2Al 2 O 3
Cu +2 O + H 2 = Cu 0 + H 2 O
Использование оксидов малоактивных металлов дпя окисления органических веществ.

Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO 2 + 2NaOH = NaNO 2 + NaNO 3 + H 2 O
Способы получения
1. Взаимодействие простых веществ - металлов и неметаллов - с кислородом:
4Li + O 2 = 2Li 2 O;
2Cu + O 2 = 2CuO;
4P + 5O 2 = 2P 2 O 5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Cu(OH) 2 = CuO + H 2 O
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
H 2 SO 3 = SO 2 + H 2 O
H 2 SiO 3 = SiO 2 + H 2 O
3. Разложение некоторых солей:
2Cu(NO 3) 2 = 2CuO + 4NO 2 + O 2
CaCO 3 = CaO + CO 2
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O
4. Окисление сложных веществ кислородом:
CH 4 + 2O 2 = CO 2 + H 2 O
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
4NH 3 + 5O 2 = 4NO + 6H 2 O
5.Восстановление кислот-окислителей металлами и неметаллами:
Cu + H 2 SO 4 (конц) = CuSO 4 + SO 2 + 2H 2 O
10HNO 3 (конц) + 4Ca = 4Ca(NO 3) 2 + N 2 O + 5H 2 O
2HNO 3 (разб) + S = H 2 SO 4 + 2NO
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).